![]()

Chapitre 18
AUTO-ANTICORPS NON SPECIFIQUES
D'ORGANES :
ANTICORPS ANTINUCLEAIRES
Les
anticorps antinucléaires (AAN) constituent un groupe hétérogène
d’auto-anticorps de spécificités diverses.
On distingue deux sous-groupes :
1/ Les anticorps d’acides nucléiques et de nucléoprotéines
Ils sont représentés par
- Les anticorps anti-ADN
- Les anticorps anti-Histones
2/ Les anticorps spécifiques d’antigènes nucléaires solubles
Ils reconnaissent des antigènes extraits de cellules thymiques ou " extractable nuclear antigens ". Ils sont représentés par
- Les anticorps anti-Sm
- Les anticorps anti-RNP
- Les anticorps anti-SS-A et SS-B
Les AAN peuvent aussi être dirigés contre des organites nucléaires tels le nucléole ou le centromère.
I – Dépistage des anticorps
antinucléaires
Toute recherche d’AAN commence par le dépistage de ces auto-anticorps quelle que soit leur spécificité. Quand la recherche est positive, elle se poursuit par l’analyse des spécificités auto-antigèniques reconnues. Un résultat négatif n’empêche pas toujours la réalisation des tests spécifiques car certains AAN peuvent échapper au dépistage initial.
A)
Techniques de détection
La technique la plus employée pour la recherche des AAN est l’immunofluorescence indirecte qui peut être réalisée soit sur coupe de foie de rat soit sur cellules Hep-2 (Tableau 1). Le sérum est testé à différentes dilutions qui sont poursuivies jusqu’à extinction de la fluorescence. L’inverse de la dernière dilution positive donne le titre du sérum.
B)
Résultats
La distribution de la fluorescence sur les coupes de foie de rat ou sur les cellules Hep-2 peuvent changer au cours des dilutions avec les qualificatifs suivants :
- " Homogène " en cas de positivité de tout le noyau, mis à part les nucléoles sans ponctuation.
- " Moucheté " en cas de présence de nombreux grains fins non comptables.
- " Nucléolaire "
-" Périnucléaire " avec un fond faible homogène etune ligne fine circulaire autour du noyau bien marquée. La plaque équatoriale est négative.
- " Centromérique ", uniquement observable sur cellules Hep2, en cas de présence d'une quarantaine de grains égaux entre eux et présents pour certains dans les nucléoles. Les points deviennent des traits au niveau de la plaque équatoriale dans les cellules en mitose.
- " A grains nucléaires multiples " si l'on rencontre de 1 à 25 grains par noyau, inégaux entre eux, non présents dans les nucléoles et non visibles dans les cellules en mitose.
Une fluorescence cytoplasmique des cellules HEp2 (mitochondries, ribosomes, filaments, etc ... ) demande un contrôle sur coupes d'organe.
L’aspect
de la fluorescence peut donner une indication sur la spécificité de
l’auto-anticorps détecté mais ne dispense pas de la réalisation de tests
spécifiques pour caractériser l’AAN.
Figure 1 : Anticorps anti-nucléaires, aspects de la fluorescence. a)
homogène ; b) nucléolaire ; c) moucheté ; d) centromérique.
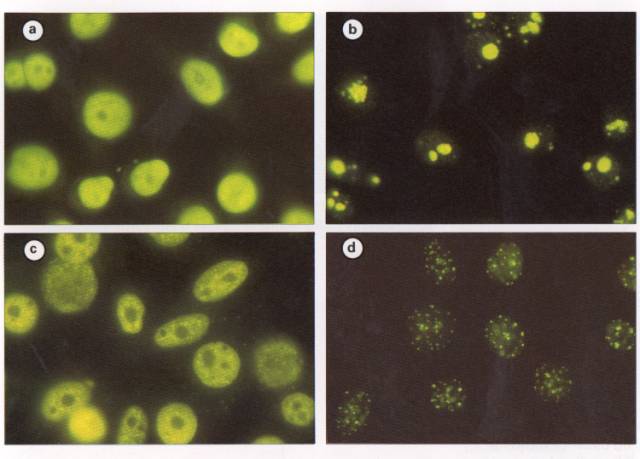
Photo : Immunologie clinique, 1991, J. Brostoff, Ed DeBoeck Université
C)
Valeur diagnostique des AAN :
On observe des AAN dans de nombreuses maladies (Tableau 2, mais c’est dans le LED que l’on retrouve les plus forts titres. Il n’existe pas de corrélation entre le titre des AAN et l’évolutivité de la maladie.
Tableau 1 : Fréquence des AAN détectés
par différentes techniques
|
Maladies |
COUPE DE FOIE DE RAT |
CELLULES Hep-2 |
|
Lupus Erythémateux Disséminé |
90 |
95 |
|
Polyarthrite Rhumatoïde |
44 |
45 |
|
Sclérodermie Systémique |
50 |
75 |
|
Syndrome de Sjögren |
56 |
52 |
|
Lupus Induit |
100 |
100 |
|
Sujets Normaux |
10 |
2 |
Tableau 2 : Fréquence des AAN dans
différentes maladies.
|
Maladies |
AAN (%) |
|
Lupus Erythémateux Disséminé |
72-100 |
|
Lupus Discoïde |
22-46 |
|
Lupus Induit |
15-77 |
|
Polyarthrite Rhumatoïde |
15-30 |
|
Syndrome de Sjögren |
40-70 |
|
Sclérodermie |
40-80 |
|
Poly- et Dermatomyosite |
8-29 |
|
Péri-Artérite Noueuse |
0 |
|
Connectivites Mixtes |
100 |
|
Myasthénie |
53 |
|
Hépatites virales |
58 |
|
Leucémie lymphoïde |
20 |
|
Sujets Normaux > 60 ans |
16 |
|
Sujets Normaux |
2 |
Figure 2 : Aspect des anticorps
anti-nucléaires sur coupe de foie de rat.
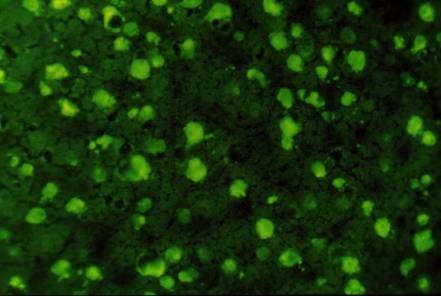
Photo : B Weill
II – Les anticorps spécifiques d’acides nucléiques
et de nucléoprotéines
A) Anticorps
anti-ADN natif
Les anticorps anti-ADN constituent un groupe hétérogène au sein duquel on distingue :
1/ Les anticorps qui se combinent exclusivement avec l’ADN natif (ADNn, bicaténaire).
Ce sont les plus spécifiques du LED, mais les plus rares. Leur présence suffit à affirmer le diagnostic.
2/ Les anticorps qui se combinent avec l’ADN natif et dénaturé (monocaténaire)
Ils sont très caractéristiques de la maladie. Ce sont les plus fréquents des anticorps anti-ADN natif.
3/ Les anticorps anti-ADN dénaturé
Ils ne sont pas caractéristiques du LED. On les observe dans plus de 50% des cas de lupus induit, et très fréquemment dans les autres connectivites et les syndromes inflammatoires de toutes étiologies. Ils sont aussi fréquents chez les personne âgées en dehors de toute maladie.
1 - Techniques de détection
Trois techniques sont actuellement utilisées pour la mise en évidence des anticorps anti-ADN natifs.
L’immunofluorescence indirecte sur Crithidia luciliae : cette technique utilise comme substrat antigénique l’ADN natif stocké dans le kinétoplaste de ce trypanosome non pathogène pour l’homme. C’est une technique très spécifique et sensible. Elle permet un dosage semi-quantitatif des anticorps, et aussi d’en définir la classe (IgG, IgM, IgA) et la capacité à fixer le complément.
Le test de Farr : ce test repose sur la détection de complexes antigène-anticorps constitués avec de l’ADN natif marqué par un radio-isotope ajouté au serum. Cette méthode, beaucoup plus sensible, detecte les anticorps anti-ADN natif de forte affinité. Ce sont ces anticorps qui sont généralement associés à l’apparition d’une glomérulonéphrite.
Les dosages immuno-enzymatiques : réalisés en phase solide, ces test sont aussi sensibles, aussi spécifiques que le test de Farr. La technique ELISA permet en outre de déterminer la classe de l’anticorps anti-ADN natif (Tableau 3).
2 - Valeur diagnostique des Ac anti-ADN natif
Les IgG anti-ADN natif sont très spécifiques du LED. Elles constituent le stigmate biologique le plus évocateur de la maladie lupique et sont présentes chez > 90% des patients à un moment donné de leur maladie .
Le titre des anticorps anti-ADN natif est corrélé avec l’évolutivité du LED ; son accroissement doit faire redouter la survenue d’une complication viscérale, notamment rénale.
Les IgM ne sont pas spécifiques et peuvent être observées dans d’autres connectivites et au cours de certaines infections virales.
Tableau 3 : Valeur diagnostic des anticorps anti ADN natifs dans le LED
|
|
Sensibilité |
Spécificité |
Valeur prédictive + |
|
IFI sur C. luciliae |
38 |
98 |
46 |
|
Test de Farr |
90 |
99 |
93 |
|
ELISA |
79 |
97 |
83 |
Figure 3 : immunofluorescence indirecte
sur crithidia luciliae.
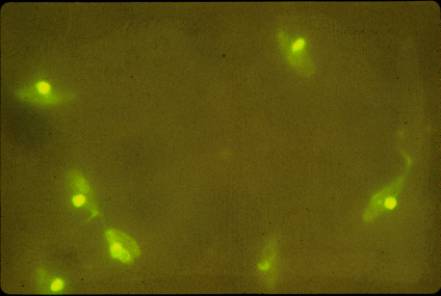
Photo : B Weill
B) Anticorps anti-Histones
Les
histones sont des protéines basiques riches en arginine et en lysine. Ces
protéines sont intrinsèquement associées à l’ADN formant ainsi la chromatine.
Il existe cinq classes différentes d’histones : H1, H2A , H2B, H3 et
H4. Des anticorps contre les différentes classes d’histones ont été décrits
dans le lupus mais ils ne sont pas restreints à cette pathologie.
1 - Techniques de détection
Les
premières techniques, représentée par la fixation du complément et l’immunofluorescence
indirecte (IFI), manquaient de reproductibilité et de sensibilité. Ces méthodes
sont aujourd’hui supplantées par des techniques immuno-enzymatiques de type
ELISA utilisant comme substrat antigénique des fractions d’histones isolées.
2 - Signification clinique des AC anti-histones
- Anticorps anti-Histones et
LED: les
anticorps anti-histones figurent parmi les auto-anticorps les plus
fréquents dans le LED. Ils sont détectés chez 70% des patients non
sélectionnés et peuvent atteindre 80% chez des patients en phase active
de la maladie. Dans le LED, des anticorps anti-histones de toute
spécificité ont été décrits avec cependant une plus grande fréquence des
anti-H1 et des anti H2B. Il existe en outre une liaison entre les
réponses autoimmunes anti-ADN et anti-Histones : chez la plupart des
patients positifs en anti-ADN, on retrouve des AC anti-Histones.
Cependant, les anticorps anti-Histones ne sont pas nécessairement
accompagné d’AC anti-ADN.
- Anticorps anti-Histones et
LED induit par les médicaments : Dans 100% des lupus induits par les
médicaments, on trouve des anticorps anti-Histones. Le dimère H2A-H2B
isolé ou associé au ADN constitue la cible préférentielle des anticorps
anti-histones dans le lupus induit par la procaïnamide. La présence
d’anticorps anti histones H2A-H2B de classe IgG est corrélée aux formes
symptomatiques des lupus induits par la procaïnamide, la quinidine, la
D-penicillamine. Ils sont retrouvés dans le lupus systémique avec une
fréquence de 15 à 20%. Dans le lupus induit par l’hydralazine, les AC
réagissent de façon préférentielle contre les histones H3 et H4 isolées,
non liées à l’ADN. Pour le diagnostic différentiel entre un LED
idiopathique et un lupus induit par les médicaments, seul compte donc un
résultat négatif, qui suggère fortement un LED idiopathique.
- Anticorps anti-Histones et
autres syndromes autoimmuns : les anticorps anti-histones sont également
détectés dans de nombreux rhumatismes inflammatoires. Leur fréquence
d’association avec la PR varie de 15% dans les formes non compliquées à
75% dans la PR compliquée avec vascularite et 83% dans la PR compliquée
d’un syndrome de Felty. Dans la PR juvénile, les anticorps anti-Histones
sont présents dans 50 à 75% des cas avec une incidence plus élevée dans
les formes avec uvéites.
Figure 4 : Différents types d’histones.
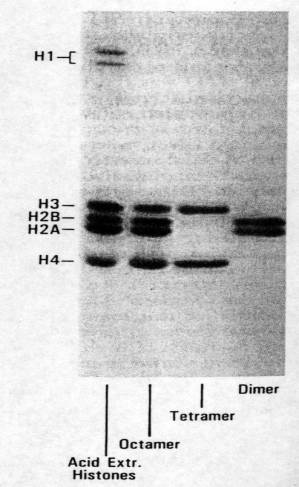
Photo :
Maladie systémiques, MF. Kahn.
C)
Anticorps anti-Centromère
Avant de se diviser, la cellule double ses chromosomes par réplication de l’ADN. Le centromère est la zone du chromosome au niveau de laquelle, pendant la mitose, les deux chromosomes frères restent attachés avant de se séparer. Il existe à ce niveau une structure appelée kinétochore qui permet l’arrimage des chromosomes sur les fibres du fuseau mitotique pour permettre leur migration vers les deux poles de la cellule. Les anticorps anti-Centromères, qui devraient plutôt être appelés anti-Kinétochore, reconnaissent différentes protéines de cette structure.
La détection des anticorps anti-centromères par IFI nécessite donc un substrat comportant de nombreuses cellules en division comme les cellules Hep-2. Sur ces cellules, les anti-centromères donnent un aspect de fluorescence caractéristique avec : sur les cellules en division un marquage des chromosomes sur la plaque équatoriale (métaphase). Sur les cellules en interphase, un marquage moucheté des noyau représenté par 46 grains fluorescents, de taille moyenne, régulière et d’intensité identique.
Ces anticorps sont essentiellement associés au syndrome CREST (cf chapitre " connectivites ", scléodermie) pour lequel leur sensibilité est de l’ordre de 95%. Il sont très rarement retrouvés dans les formes systémiques de sclérodermie pour les quelles on retrouve des anti-Scl70. si bien que certains auteurs considèrent la présence d’anti-centromère et d’anti-Scl70 comme mutuellement exclusive.
Les anticorps anti-centromères peuvent aussi être mis en évidence chez des malades atteints de cirrhose biliaire primitive, maladie parfois associée aux sclérodermies. Il s’agit le plus souvent d’une forme CREST.
III – Les anticorps spécifiques
d’antigènes nucléaires solubles
La recherche d’anticorps spécifiques d’antigènes nucléaires solubles présents dans des extraits de cellules thymique de lapin permet de reconnaître des anticorps spécifiques de certaines ribonucléoprotéines et d’ARN.
A -
Techniques de détection
Il existe plusieurs méthodes d’identification des anticorps spécifiques
- L’hémagglutination passive est réalisée à l’aide d’hématies recouvertes d’antigènes nucléaires. Seuls les anticorps anti-Sm et anti-RNP peuvent être détectés ainsi. Cette technique est obsolète.
- L’immunodiffusion double en gélose et la contre-immunoélectrophorèse. Ces méthodes reposent sur le principe de l’immuno-précipitation en présence d’extrait de cellules thymiques de lapin. Cet extrait permet la détection de la plupart des anticorps anti-ECT. Certains anticorps nécessitent cependant l’utilisation d’autres substrats pour leur mise en évidence (thymus de veau ou rate humaine pour les anticorps anti-Ro/SS-A).
- Méthodes Immunoenzymatiques
Les dosages de type ELISA ne sont pas entré en pratique courante à cause de la difficulté d’obtenir une gamme complète d’ antigènes purifiés. Les antigènes recombinants produits par génie génétique se revèlent decevants car constitués uniquement des chaînes protéiques de la ribonucléoproteine.
B - Les
différents anticorps anti-ECT
1- Anticorps anti-Sm
Les AC anti-Sm, dénommés d’après la malade chez qui ils ont été décrits, ont été initialement identifiés par Eng Tan en immunodiffusion. Ces anticorps sont hautement caractéristiques du LED. Ils sont présents dans 10 à 25% des sérums de patients.
Les
anticorps anti-Sm précipitent une famille de protéines associées à différentes
chaînes d’ARN. Les auto-antigènes reconnus par les anticorps anti-Sm
appartiennent à la famille des Usn RNP. Les Usn RNP sont des particules
nucléaires composées de petits ARN et de proteine. Les ARN constituant ces
particules sont riches en Uridine d’ou le préfixe Usn RNP. On a identifié 13
Usn RNP. Les anticorps anti-Sm reconnaissent 5 déterminants antigéniques
appelés B’/B,D,E,F et G. Ces déterminants antigéniques sont communs aux U1, U2,
U4 RNP. Des études immunogénétiques ont montré l’association des anticorps
anti-Sm avec l’antigène HLA DR7.
Si tous les travaux s’accordent sur la valeur diagnostique des anticorps anti-Sm, leur intérêt pronostique n’a pas été établi. En effet, la présence et le titre des anticorps anti-Sm ne sont pas corrélés avec l’évolutivité de la maladie ni avec une atteinte viscérale.
2- Anticorps
anti-U1RNP
Les anticorps anti-RNP, ont été identifiés par Sharp en 1971 par immuno-diffusion dans le sérum de patients atteints de connectivite mixte, dont ils constituent le marqueur sérologique. typiquement associé avec les anti-Sm. Ils reconnaissent le polypeptide de 70Kd de la molécule de U1-RNP et les déterminants A et C de la protéine.
Ils sont retrouvés dans le LED avec une fréquence de 25 à 30%, mais aussi au cours de la polyarthrite rhumatoïde, de la sclérodermie, de la polymyosite, et même dans le lupus induit par les médicaments.
Les molécules Sm et U1RNP interviennent dans l’épissage des ARN pré-messagers.
3- Anticorps anti-Ro/SS-A
La première description des anti-Ro/SS-A et des anti-La/SS-B remonte à 1962. Les systèmes Ro/SS-A et La/SS-B sont similaires aux systèmes Sm et U1-RNP.
Ils sont constitués par des particules intracellulaires composés de
protéines complexées à de petits ARN. Le motif antigénique reconnu par les anticorps
est porté par la partie protéique de la ribonucléoprotéine. L’antigène Ro/SS-A
est composé d’au moins deux protéines de 60 et 52 kDa complexées avec de petits
ARN cytoplasmiques appelés Y1, Y2, Y3, Y4 et Y5. Ces ARN sont synthétisés dans
le noyau sous le contrôle d’une ARN polymérase III. La fonction de la protéine
Ro est encore inconnue.
Les
substrats antigéniques classiquement utilisés pour la détection des anticorps
anti-nucléaires sont peu adaptés à la recherche des anticorps anti-Ro. En effet,
les anticorps anti-Ro ne sont généralement pas détectés par IFI, et rarement
sur cellules Hep-2. Les extraits de cellules thymiques utilisés pour la
détection des autres anticorps antinucléaires sont peu riches en antigène Ro.
On leur préfère des préparations de Ro purifié à partir de splénocytes humains.
La présence des anticorps anti-Ro est associée à deux grandes connectivites : le lupus érythémateux disséminé (30% des LED) et le syndrome de Gougerot-Sjögren ( 70% des GS primaires, 30 % des GS secondaires) :
o Au cours du LED, les anti-Ro sont associés environ une fois sur trois à des anticorps anti-La/SS-B. Des études immunogénétiques ont montrés l’association de l’anti-Ro avec l’antigène DR3 et un déficit en C4A ou avec l’antigène DR2 (lupus avec déficit en C2) Les lupus avec déficit en C2 ont rarement des taux élevés d’anticorps antinucléaires et anti-ADN mais ils ont plus d’une fois sur deux des anti-Ro (cf chapitre " complément ").
o Cinq à dix % des lupus n’ont pas d’anticorps antinucléaires. chez ces 60% de ces patients, les AC anti-Ro constituent le seul stigmate biologique. Les formes négatives en anticorps antinucléaires et positives en anti-Ro correspondent généralement à des lupus subaigus caractérisés par une atteinte cutanée extensive.
o Le bloc auriculo-ventriculaire congénital et le bloc de branche : il surviennent chez le nouveau-né de mère lupique avec anti-Ro une fois sur vingt mais aussi chez le nouveau-né de mère atteinte de n’importe quelle connectivite avec AC anti-Ro. Dans sa forme modérée, le bloc auriculo-ventriculaire peut être transitoire. Dans sa forme grave, il peut aboutir à la mort foetale. Les anticorps anti-Ro ont une responsabilité directe dans le trouble de la conduction, en se fixant sur les cellules du faisceau de His. La présence d’anticorps anti-Ro dans le sang maternel impose donc une surveillance fœtale accrue. Ces enfants ont souvent, en outre, un lupus néonatal.
o Le lupus néonatal : le nouveau né présente une éruption cutanée annulaire du visage, du cuir chevelu et du tronc parfois dès la naissance, plus souvent après quelques jours d’exposition à la lumière. Cette éruption disparaît en moins de six mois pour ne plus récidiver. Les anti-Ro responsables de cette affection sont d’origine maternelle comme en atteste leur disparition du sérum du nourrisson vers le sixième mois. Ils sont directement impliqués dans la pathogénie du lupus néonatal par lymphocytotoxicité dépendante des anticorps.
4- Anticorps anti-La/SS-B
Le
complexe La/SS-B est constitué d’une protéine phosphorylée de 48kD couplée à
des ARN transcrits par l’ARN polymérase III. Les ARN identifiés correspondent
aux précurseurs de l’ARNt et de l’ARN ribosomal 5S et 7S. Certains ARN
d’origine virale (EBV, VSV) peuvent être associés à la protéine La.
La
protéine La se liant presque exclusivement à des ARN synthétisés par la ARN
polymérase III, certains auteurs lui auraient trouvé un rôle dans l’assemblage
de ce type d’ARN.
Les
anticorps anti-La/SSB sont rares au cours du lupus. On les retrouve seulement
dans 5 à 15% des cas. Leur présence incite à rechercher l’association à un
syndrome de Gougerot-Sjögren.
Les AC anti-La sont presque toujours associés aux AC anti-Ro dans les sérum, mais la réciproque n’est pas vraie. Les anticorps anti-La/SS-B sont retrouvés chez les patients atteint de syndrome de Gougerot-Sjögren primaire, dans ce cas, la prévalence moyenne des anti-La est d’environ 70% au cours du GS primaire et de 5 à 15% des GS secondaires.
5- Anticorps anti-Ma
Ils sont fréquents dans le lupus et accompagnent surtout des lupus graves avec atteinte rénale et hypertension artérielle, et atteinte neurologique.
6- Anticorps anti-PCNA
L’antigène
PCNA est une protéine de 36 kD identifiée comme une protéine auxiliaire de
l’ADN polymérase delta. Recherchés par immunofluorescence sur cellules Hep-2,
ils sont présents chez moins de 5% des sujets lupiques. Ils caractérisent les
LED avec atteinte rénale grave et atteinte neurologique.
Figure 4 : Anticorps
anti-ribonucléoprotéines dans le LED
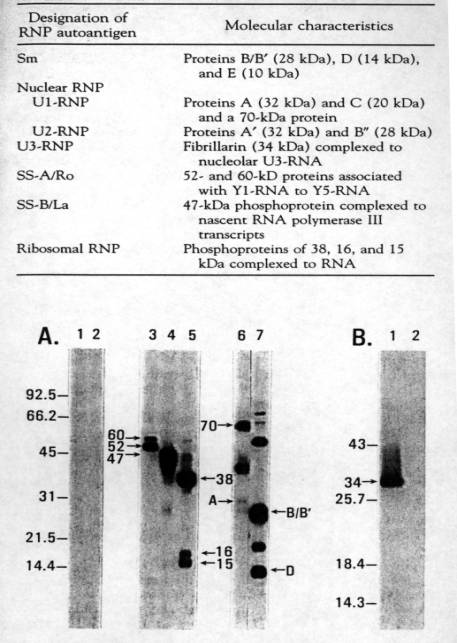
(A) 1 et 2 : Sérum normal ; 3 :
SSA ; 4 : SSB ; 5 : Protéine ribosomale ; 6 :
U1-RNP ; 7 : Sm.
Tableau 4 : Anticorps antinucléaires
dans le LED
|
Type d’anticorps |
Fréquence (%) |
|
Anticorps antinucléaires totaux |
95-100 |
|
Anti-ADN natif * |
55-98 |
|
Anti-ADN dénaturé |
50-87 |
|
Anti-Histones |
30 |
|
Anti-Sm * |
30 |
|
Anti-RNP |
12-39 |
|
Anti-Ro/SS-A |
25-35 |
|
Anti-La/SS-B |
5-15 |
|
Anti-PCNA * |
5 |
|
Anti-Ma * |
20 |
*
Anticorps caractéristiques de la maladie lupique
Pour suivre l’évolution d’un LED : Anti-ADN natif et complément sérique.
Tableau 5 : Fréquences des différents
antinucléaires dans les différentes connectivites
|
|
ADN natif |
histone |
Sm |
RNP |
Ro |
La |
PCNA |
Scl 70 |
Centomère |
JO1 |
PmScl |
|
LED |
90 |
70 |
30 |
35 |
50 |
15 |
5 |
- |
- |
- |
- |
|
LIM |
rare |
95 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
CMS |
- |
- |
- |
100 |
- |
- |
- |
- |
- |
- |
- |
|
PR |
- |
15 |
- |
- |
- |
- |
- |
- |
- |
- |
- |
|
SS |
- |
- |
- |
- |
70 |
50 |
- |
- |
- |
- |
- |
|
Scl distale |
- |
- |
- |
10 |
- |
- |
- |
80 |
- |
- |
- |
|
Scl Proximale |
- |
- |
- |
- |
- |
- |
- |
- |
90 |
- |
- |
|
Poly-myosite |
- |
- |
- |
- |
- |
- |
- |
- |
- |
30 |
5 |
7- Anticorps anti-Scl-70
L’appellation de ces anticorps viens de leur fréquence dans les formes systémiques de sclérodermie et du poids moléculaire (70kD) initialement attribué à l’antigène correspondant.
Cet
antigène a été identifié comme la topoisomérase I qui joue un rôle dans la
transcription de l’ADN. En IFI sur cellules Hep-2, les anticorps anti-Scl70
donnent en général un aspect assez caractéristique : les noyaux présentent
un marquage homogène ou constitué de grains très fins et tres sérrés. Cet
aspect moucheté fin et dense peut être associé à un marquage périphérique du
nucléole. Les cellules en division présentent un marquage dense de la
chromatine.Ces aspects évocateurs doivent faire pratiquer une identification
spécifique des anticorps. Elle peut être effectuée par différentes
techniques : contre-immunoélectrophorèse, western blot ou ELISA en
microplaque. Quelle que soit la technique, la qualité de la préparation
antigénique conditionne le résultat.
Les
anticorps anti-Scl70 sont présents dans environ 50% des sclérodermies
systémiques mais ne sont pas tout à fait spécifiques de cette maladie puisqu’on
peut les observer au cours de certains LED.
8- Anticorps anti-Jo1
L’antigène est Jo1 présent dans le
noyau des hépatocytes de veau et les fibres musculaires humaines. Les anticorps
spécifiques donnent en IFI un aspect mouchete. L’antigène Jo1 est résistant à
la DNAase et à la RNAase mais est sensible à la trypsine. Son poids moléculaire
est de 150 kDa.
L’AC
anti-Jo1 est présent dans 31% des PM, particulièrement en cas d’atteinte
pulmonaire, 4.5% des DPM et 4.5% des formes intriquées avec d’autres
connectivites. En revanche, on ne les retrouve pas dans les connectivites en
l’absence d’atteinte polymyositique, ni dans les dystrophies musculaires non
inflammatoires.
9- Anticorps anti-PM/Scl
Ils donnent une fluorescence nucléolaire homogène. Ils reconnaissent des antigène solubles du nyau constitués de 11 protéines de poids moléculaire de 20 à 110 kD. Leur nom vient de leur présence dans les syndromes de chevauchement associant des signes de polymyosite et des signes de sclérodermie avec un risque élevé d’atteinte rénale.
10 - Les
anticorps anti-Nor 90
Ils
reconnaissent un constituant de 90kD situé au niveau du centre organisateur du
nucléole. Ils donnent une fluorescence nucléolaire mouchetée. Ils ne sont pas
spécifiques des sclérodermies et sont fréquemment retrouvés dans le syndrome de
Gougerot-Sjögren.
11 - Les
anticorps anti-Ku
Il
reconnaissent une protéine non histonique de la chromatine de 80 kD. Il peuvent
donner une fluorescence nucléolaire mais sont plus souvent responsables d’un
marquage nucléaire réticulé. Comme les anti-PM/Scl, ils sont fréquemment
rencontrés dans les syndromes de chevauchement entre polymyosite et
sclérodermie.
12 - Les anticorps
anti-PM1
Ils
ont été décrits par REICHLIN par immunoprécipitation entre un sérum de malade
et un extrait de thymus de veau. Ces anticorps sont présents dans 60% des
polymyosites, 17% des dermato-polymyosites, et 85% des polymyosites associées à
une sclérodermie. En dehors des chevauchements avec la sclérodermie, cet
autoanticorps ne permet pas de définir une forme clinique particulière de
polymyosite.
C – Interprétation des anticorps
anti-ECT
Les Ac anti-ECT permettent de
poser le diagnostic de connectivite, mais, en dehors des Ac anti-Sm qui sont
hautement caractéristiques du LED, ils ne permettent généralement pas de préciser
la nature de la connectivite et ne sont souvent que des éléments d'orientation.
Tableau 6 : Interprétation des anticorps anti-ECT.
|
Ac |
maladie |
Ag |
|
|
anti-Sm |
10-30% LED |
B-B'
29kD D 16 kD U1,2,4,5,6
ARN |
|
|
anti-U1RNP |
CM
de Sharp 35%
des LED 15%
des SCL PR, PM |
A 22
kD C 33
kD U1
ARN |
|
|
anti-PCNA |
< 10% LED |
prot auxil de la d ADN polymér 36 kD |
Glomérulo- Néphrite grave |
|
anti-SCL70 |
50%
des Scl systémiques qques LED |
ADNtopo-isomérase
I 70 kD
|
non associé à anti- centromère |
|
anti-La/SS-B |
50%
des GS 1 20%
des GSII 10% des LED |
RNAse polymérase III 47 kD |
ass.
anti-Ro |
|
anti-Ro/SS-A |
80%
des GS 1 40%
des GSII 30% des LED |
52 kD
|
- LED
séro - - Déf C2 - grossesse |
|
anti-Jo1 |
50%PM
avec atteinte resp |
Histidyl tRNA synthétase |
|
|
anti-Ku |
PM, Scl, LED |
complexe p70/p80 |
|
|
anti-PM/Scl |
PM, Scl |
PM/Scl-100 PM/Scl-75 |
|
Facteurs rhumatoïdes
Au cours de la maladie rhumatoïde (PR), l’anomalie immunologique la plus fréquente est la présence dans le sang d’autoanticorps à spécificité antiglobuline, les facteurs rhumatoïdes (FR). Ce phénomène est à la base des techniques que l’on utilise couramment pour confirmer le diagnostic de PR.
I – Techniques de détection des FR
Ces méthodes, basées sur l’agglutination passive, sont limitées à la mise en évidence des facteurs rhumatoïdes agglutinants, appartenant à la classe des IgM.
A)
Réaction de Waaler-Rose
Waaler (1940) et Rose (1948) ont montré que le sérum de la plupart des malades atteints de PR agglutine des hématies de mouton " sensibilisées " par une dose sub-agglutinante de serum de lapin anti-hématie de mouton. Ce phénomène correspond à la présence d’un FR réagissant avec les Ig de lapin fixées à la surface des hématies.
La technique princeps nécessitait l’absorption des anticorps naturels anti-hématies de mouton présent dans le sérum humain et qui auraient pu interférer avec la mise en évidence du FR. Aussi recourt-on généralement à la technique de Podliachouk, Eyquem et Jacqueline qui utilise comme support, des hématies humaines O Rh. Cette méthode se prête à une détermination semi-quantitatve par la méthode des dilutions. La dilution correspondant au dernier tube positif (dilution limite) indique la richesse du serum. La réaction de Waaler-Rose est négative pour les dilutions inférieures ou égales au 1/16 et positive au 1/32 et au dessus.
B)
Réaction au Latex de Singer et Plotz
Des billes de latex peuvent fixer par adsorption les gamma-globulines humaines de la fraction II de Cohn. Ce réactif est mis en présence de dilutions de sérum puis les tubes sont chauffés 2 heures à 56°C, puis laissés à reposer jusqu’au lendemain. Après centrifugation douce, l’observation d’agglutinats blancs remis en suspension dans un liquide clarifié traduit la positivité alors que les tubes négatifs contiennent un réactif opalescent. La réaction est considérée comme positive pour des taux égaux ou supérieurs au 1/80.
C) Techniques
immuno-enzymatiques et néphélométriques
Parmi les explications possibles des formes sans FR, figure la sensibilité moyenne des réactions d’agglutination et l’éventualité de FR non agglutinants appartenant à d’autres classes que les IgM. Le développement de méthodes immunoenzymatiques en phase solide et néphélométriques en phase liquide permettent de pallier ces inconvénients et augmente la fréquence de détection des FR.
D)
Valeur diagnostique des Facteurs Rhumatoïdes
Les techniques classiques, utilisées depuis plus de 50 ans, restent à la base de la pratique sérologique en matière de maladie rhumatoïde, grâce à leur simplicité et à leur fiabilité. Toutefois, les méthodes immunoenzymatiques en phase solide plus spécifiques tendent à les supplanter progressivement.
La réaction de Waaler-Rose est positive dans 70 à 75% des cas de PR, mais souvent après 18 à 24 mois d’évolution, ce qui limite sa valeur pour assurer précocement le diagnostic de PR. Trente % des patients atteints de PR restent négatifs en FR tout au long de l’évolution de leur maladie.
Au cours de la PR, une réaction positive reste habituellement positive. Le titre d’agglutination augmente où reste stable au cours du temps mais il est exceptionnel de constater une diminution au cours de l’évolution et a fortiori une négativation, même chez les malades traités avec succès.
Il arrive, dans un tiers des cas de positivité, que le texte au latex soit positif alors que le test de Waaler Rose reste négatif. Cette dissociation s’explique parce que la spécificité du test au latex pour la PR est moins élevée que celle du Waaler Rose. Il en est de même pour les techniques immuno-enzymatiques et néphélométriques. En revanche, la dissociation opposée, avec un test de Waaler Rose positif et un latex ou un autre test négatif n’existe pas.
La positivité des FR n’est ni nécessaire ni suffisante pour autoriser
à définir une polyarthrite comme rhumatoïde puisque des résultats peuvent être positifs en
dehors de la PR : 5 % des sujets sains ont un FR, de même que 20 à 30% des
patients lupiques chez qui la positivation est souvent précoce et le taux
variable dans le temps. Des FR peuvent en outre être retrouvés dans diverses
maladies qui ont en commun des signes d’inflammation ou d’infection chronique
(hépatite virale, syphilis, grippe, sarcoïdose)
Tableau 7 : Valeur diagnostique des
facteurs rhumatoïdes.
|
Anticorps |
Fréquence (%) |
|
Facteurs Rhumatoïde (IgM anti IgG) Réaction de Waaler-RoseRéaction au Latex |
85% 90% |
|
Ac anti-Cytokératine (fillagrine) |
40-50% (spécificité >95%) |
|
AAN |
35% |
|
Ac anti-ADN natif |
0% |
|
Ac anti-Ro/SS-A |
Rare sauf si SGS associé |
|
Ac anti-La/SS-B |
Rare sauf si SGS associé |
III – Spécificité des facteurs
rhumatoïdes
Les facteur rhumatoïdes sont des Ig sériques caractérisées par une activité anticorps dirigée contre des déterminants antigéniques du fragment Fc des IgG.
A)
Isotypie des Facteurs Rhumatoïdes
Les facteurs rhumatoïdes mis en évidence par les réactions classiques d’agglutination appartiennent à l’isotype IgM. Comme toutes les IgM, les FR possèdent 10 sites de fixation dont 5 seulement paraissent fonctionnels simultanément. Les facteurs rhumatoides non agglutinants dont l’existence est démontrée par radio-immunologie sont des IgG ou des IgA. Etant toujours accompagnés de FR IgM, ils ne sont pas systématiquement recherchés chez les patients, d’autant qu’ils ne caractérisent pas des formes particulières de la PR.
B)
Spécificité Facteurs Rhumatoïdes
De nombreux sites antigéniques situés sur les IgG natives ou dénaturées sont capables de se combiner avec les sites anticorps des FR. On peut les retrouver soit sur des molécules d’Ig animales, soit sur des molécules d’IgG humaine homologue, isologues ou même autologues, expliquant ainsi la diversité des réactifs animaux ou humains utilisables pour la sérologie de la PR. Dans tous les cas, ces sites antigéniques sont situés sur le fragment Fc de la molécule d’IgG
C)
Rôle des Facteurs Rhumatoïdes
La
présence des facteurs rhumatoïdes dans le sérum ou le liquide synovial est
indéniablement un témoin des anomalies immunitaires qui sous tendent la PR. Le
rôle du FR reste cependant assez discuté. Il est possible que les FR ne soient
que des épiphénomènes de la réaction auto-immunitaire qui caractérise la PR, et
il n’est pas sûr qu’ils jouent un rôle physiopathologique.
Tableau 7 : Spécificité des facteurs
rhumatoïdes.
|
|
FR+
|
|
Population normale 20-40 ans 40-60 ans |
0% 4% |
|
Polyarthrite Rhumatoïde |
85-90% |
|
Arthrite chronique juvénile |
20% |
|
LED |
20% |
|
SGS |
50-90% |
|
Hépatites chroniques |
10-20% |
|
Infection à mycobactéries |
5-10% |
|
Waldenström |
15% |
Anticorps
anti-Cytokératine
I – Définition
Les anticorps anti-stratum corneum ou anti-cytokératine (ACK) et AC anti-périnucléaires (APF), de découverte récente, semblent avoir une spécificité plus grande pour la PR. Ils ont probablement un grand avenir pour le diagnostic de la maladie.
En effet si la sensibilité de ces anticorps est moyenne (43% pour les
ACK et 70% pour les APF) leur spécificité est très élevée (99% pour les ACK et
97% pour les APF).
L’épitope
reconnu par les APF n’a pu encore être identifié avec certitude (peut-être la
pro-filaggrine) ; en revanche, Simon et Serre ont apporté des arguments
très solides pour établir que la filaggrine humaine était la véritable cible
des anticorps reconnus par les anti-CK. En effet, le sérum des patients atteint
de PR reconnaît en western blot une protéine de poids moléculaire 37 à 40 kD
identique à celui de la filaggrine. Cette protéine est reconnue par des
anticorps monoclonaux anti-filaggrine et le titre des sérums en ACK chute si on
pré-adsorbe ces sérums sur de la filaggrine.
La
filaggrine est une protéine très riche en histidine. Elle dérive d’une
promolécule, la profilaggrine. La profilaggrine est stockée dans une forme
insoluble et non fonctionnelle dans les granules kératohyalins des couches
hautes des épithéliums kératinisants ou semi-kératinisans. La structure de la
profilaggrine n’a pu être précisée qu’avec le clonage du gène correspondant. Le
gène de la profilaggrine, situé sur le bras court du chromosome 21, code pour
10 à 13 répétitions d’une même séquence de 972 paires de bases (codant pour la
filaggrine), séparées par une séquence unique de 21 paires de bases. De plus, non
seulement le nombre de séquences de 972 paires de bases peut varier de 10 à 13
(pour un même gène), mais surtout on enregistre des variations très grandes
dans la composition de ces bases tant d’un individu à l’autre que d’un tronçon
de filaggrine à l’autre. Ces polymorphismes génétiques sont responsables d’une
grande variabilité dans la composition en acides aminés de la filaggrine :
ainsi 40% des acides aminés peuvent différer entre deux filaggrines d’un même
sujet. De plus, outre ces polymorphismes génétiques, la molécule de filaggrine
peut aussi subir des modifications post-traductionnelles. Ces modification
portent sur la transformation d’arginine en citrulline. Cette modification est
fondamentale dans l’immunogénicité de la protéine puisqu’il est aujoud’hui
clairement établi que les anticorps anti-cytokératine retrouvés dans le sérum
des patients atteints de PR reconnaissent des épitopes citrullinés de la
molécule de filaggrine.
II - Techniques de détection des APF
et des ACK
- Immunofluorescence indirecte : les APF sont détectés sur foie de rat ou sur cellules Hep2. L’ œsophage de rat a été la première méthode décrite pour la détection des ACK. La méthode classique de dilution-titrage permet une évaluation semi-quantitative du titre. L’aspect typique de la fluorescence sur œsophage de rat montre un marquage en filet ou en réseau de la couche cornée. Seules les IgG sont spécifiques de la PR.
Les
anticorps anti-cytokératines sont aussi capables de réagir avec la couche
cornée d’épiderme humain. Malheureusement, ce substrat est peu utilisable pour
la détection des ACK car il détecte aussi des auto-anticorps de classe IgG
dirigés contre des cytokératines épidermiques et présentes dans de nombreux
sérum humains normaux.
Figure 4 : Aspect des anticorps anti-cytokératine sur coupes
d’œsophage de rat
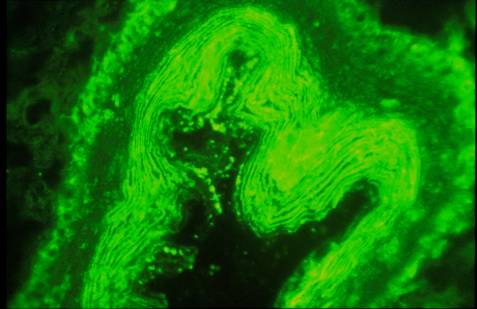
Photo : B Weill
-
Immunoempreinte (Western blot)
La
détection des anticorps anti-cytokératines peut être effectuée par
immuno-empreinte en utilisant comme préparation antigénique un extrait
d’œsophage de rat. Dans le cas de la méthode par immunoempreinte on peut aussi
utiliser comme antigène un extrait d’epiderme humain.
Anticorps anti-Phospholipides
II - Définition
Ils caractérisent le syndrome des anti-phospholipides décrit par Soulier et Boffa en 1981, qui associe des avortements à répétition, des thromboses veineuses et artérielles, centrales et périphériques, et un anticoagulant circulant.
Ce syndrome est soit autonome (syndrome des anti-phospholipides primaire), soit associé à une connectivite (syndrome des anti-phospholipides secondaire).
II - Détection et interprétation des Ac
anti-phospholipides
Ce sont des auto-anticorps qui reconnaissent différents auto-antigènes lipidiques :
o cardiolipine (structure proche de la phosphatidylsérine)
o acide phosphatidique
o phosphatidylinositol
o phosphatidyléthanolamine
o On les détecte par ELISA en présence de certains co-facteurs comme la bêta 2-GPI, apportés par le sérus utilisé pour saturer les puits de la plaque de microtitration.
En pratique courante, seule la détection des Ac anti-cardiolipine est réalisée car ils sont les plus fréquents. Leur spécificité pour le syndrome des anti-phospholipides est de 75 %. Leur sensibilité est environ de 70 %. Les Ac anti-cardiolipine peuvent être aussi détectés dans certaines infections, notamment virales, la cirrhose, la sarcoïdose et certains cancers.
En présence de la bêta 2-GPI, la cardiolipine forme un complexe reconnu par des Ac dits " anti-bêta 2-GPI " qui se combinent en réalité avec un épitope conformationnel du complexe. Les Ac anti-bêta 2-GPI ont une spécificité de 96 % pour le syndrome des anti-phospholipides, et une sensibilité de 50 %. On ne les rencontre donc que dans le syndrome des anti-phospholipides.